Prothèse de croissance dans la chirurgie conservatrice des sarcomes osseux du membre inférieur de l'enfant.
Expérience de 12 ans et évolution.
Nicole DELEPINE, Gérard DELEPINE.
Cette publication a été réalisé dans "Prothèses de reconstruction pour tumeurs osseuses".
Pages 23 à 30 - 8ème Séminaire P.E.R.F.E.C.T.O. - 8 mars 1996
INTRODUCTION :
Depuis que la chimiothérapie néoadjuvante et une chimiothérapie postopératoire lourde a permis une survie prolongée à une grande majorité des enfants atteints d'ostéosarcome ou de sarcome d'Ewing, la nécessité de traitements locaux assurant une meilleure qualité de vie s'est progressivement imposée.
Si la résection monobloc suivie de reconstruction par prothèse massive est maintenant couramment pratiquée chez l'adulte et le grand adolescent, cette technique se heurte, chez l'enfant, au problème de l'inégalité future des membres inférieurs. La mise en place d'une prothèse ordinaire chez un enfant de moins de 13 ans risque d'aboutir à une inégalité sévère des membres inférieurs (figure 1) diminuant l'intérêt fonctionnel de la chirurgie conservatrice. C'est pourquoi de nombreux enfants jeunes, atteints de sarcomes osseux du membre inférieur, sont encore amputés ou subissent une intervention de retournement du pied selon la technique de Van Ness qui transforme une amputation de cuisse en amputation de jambe obtenant ainsi une fonction moins mauvaise au prix d'un préjudice esthétique majeur (figure 2) mal supporté dans nos populations latines.
C'est dans ces indications que nous avons, depuis 1984, réalisé des prothèses de croissance actives du fémur inférieur et plus récemment du tibia et fémur supérieur dont nous présentons, ici, les caractéristiques techniques et les résultats cliniques à moyen terme avant d'envisager les développements futurs.
PATIENTS :
De 1984 à 1995, nous avons réalisé une chirurgie conservatrice avec reconstruction par prothèse de croissance chez 27 malades. Il s'agissait d'enfants âgés de 4 ans et demi à 13 ans. La prothèse de croissance posée était tibiale dans 4 cas (figure 3), fémorale supérieure dans 2 cas (figure 4), fémorale inférieure dans 16 cas (figure 5) et il s'agissait de prothèse de fémur entier dans 5 cas.
Sept patients étaient atteints d'un sarcome d'Ewing, 20 patients souffraient d'ostéosarcome. Vingt malades ont été vus de première main avec une tumeur localisée. Un malade a consulté pour une récidive locale d'un sarcome d'Ewing traité initialement ailleurs par radiothérapie. Trois malades ont été vus avec progression métastatique apparu lors d'une chimiothérapie préopératoire longue ; les trois derniers malades étaient vus sans traitement préalable mais déjà métastatiques. La taille moyenne de résection est de 15,5 cm.
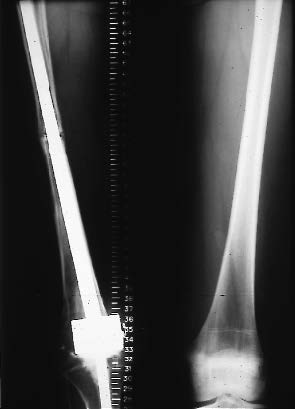
Figure 1 : Malade opéré à l'âge de 11 ans d'un ostéosarcome du fémur inférieur. Mise en place d'une prothèse massive. Inégalité résultante en fin de croissance.

Figure 2 : Aspect morphologique de l'intervention de Van Ness (retournement du pied).
LES PROTHESES :
Eléments communs :
Les prothèses ont été réalisées en titane ; ce métal a été choisi pour ses qualités mécaniques supérieures à l'acier, en particulier son plus faible poids et sa plus grande élasticité, et pour permettre l'utilisation d'ondes électro-magnétiques sans artéfact majeur. Les prothèses ont été fabriquées, pour chaque patient, selon les recommandations du chirurgien en fonction de la résection osseuse prévue.
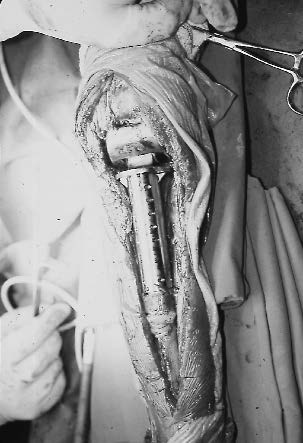
Les prothèses de fémur supérieur se composent d'un cotyle, d'une épiphyse standard et d'une métaphyse de croissance active (figure 4c et 4d).
 |
 |
 |
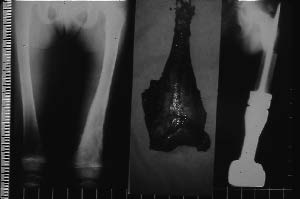
| Figure 3 : Tumeur de l'extrémité supérieure du tibia. Résection- reconstruction par prothèse de croissance. |
Figure 4a : Volumineux sarcome du fémur supérieur chez une jeune fille de 11 ans traitée ailleurs. |
Figure 4b : Pièce de résection. |
Les prothèses de genoux (figure 5) comportent toutes 3 éléments : une partie épiphysaire standard reliée à une partie métaphyso-diaphysaire de croissance active et une partie tibiale ou fémorale du versant non tumoral du genou, de petite taille et non cimentée afin de respecter la croissance naturelle du cartilage de conjugaison conservée (figure 6 et figure 7).
La taille de la partie épiphysaire des prothèses est suffisamment petite pour être insérée chez un enfant de 5 ans et ses angles lisses évitent les lésions des tissus mous. La nécessité d'une stabilité parfaite de l'articulation lors des manoeuvres d'allongements impose dans tous les cas une articulation à charnière.
Les éléments de croissance active ont évolué au cours du temps :
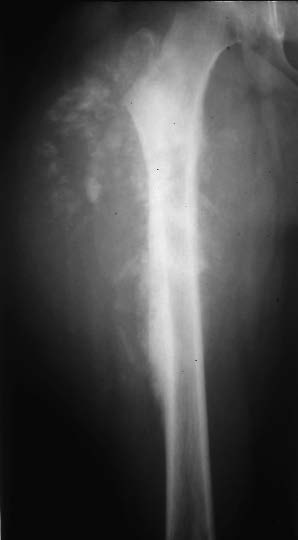
- Les éléments de croissance de première génération (figure 5) comportaient une vis sans fin actionnée par un tournevis et un système anti-retour insuffisamment efficace.
Pour maintenir l'allongement obtenu, une cale de ciment acrylique était réalisée après chaque séance d'allongement. Pour cette raison, chaque allongement nécessitait une large incision, augmentant le risque d'infections.
La nécessité d'un abord large imposait un nombre d'allongements aussi réduit que possible et donc des allongements importants (2 à 3 cm), traumatisants pour les muscles et pour la mobilité articulaire.
 |
 |
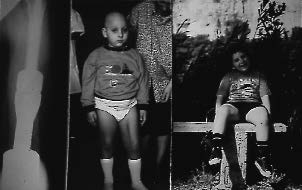 |
| Figure 4c : Prothèse de croissance du fémur supérieur. |
Figure 4d : Radiographie de la prothèse en place. |
Figure 5 : Tumeur de l'extrémité inférieure du fémur. Résection-reconstruction par prothèse de croissance. Aspect du membre inférieur après 5 ans. |
 |
 |
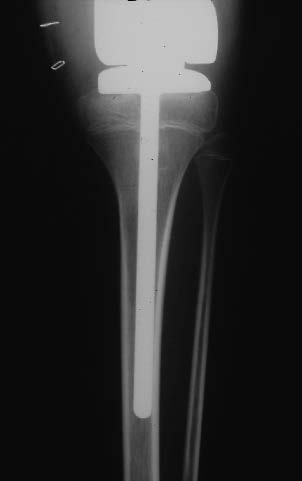
| Figure 6 : Radiographie de l'élément tibial pour prothèse de croissance fémorale inférieure. Cet élément n'est pas cimenté et ne stérilise pas le cartilage de croissance tibiale. Il permet ainsi une croissance normale du tibia, la croissance du fémur étant assurée par l'élément à croissance active. |
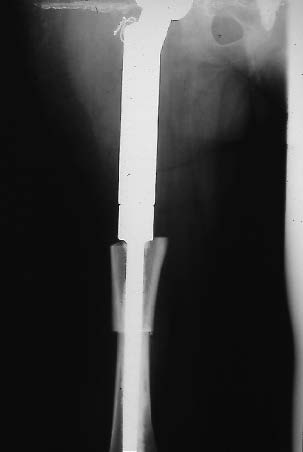
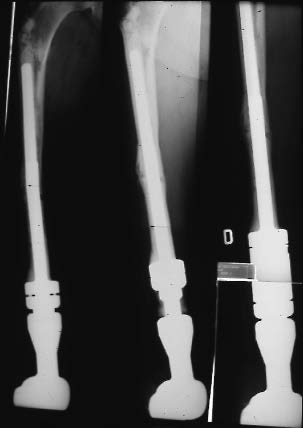
Figure 8 : Radiographie d'une prothèse de croissance fémorale inférieure de première génération avant et après allongement. Sur le cliché de droite, remarquer l'entretoise podée lors de la remise à zéro de la crémaillière d'allongement. |
 |
 |
| Figure 7 : Pièce tibiale non cimentée posée pour prothèse de croissance du fémur inférieur 3 ans auparavant. Longueur égale des deux tibias. |
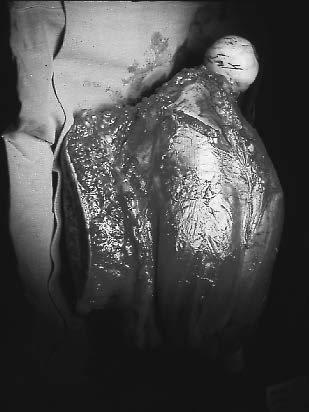
Figure 9 : Prothèse de croissance fémorale inférieure première génération après allongement. Morphologie du malade à côté de sa mère. |
- Les éléments de croissance de deuxième génération bénéficient d'un système anti-retour efficace. L'allongement peut être ainsi réalisé lors d'une arthroscopie par des incisions pontiformes (figure 10) diminuant ainsi le traumatisme cutané et musculaire, le préjudice esthétique et le risque infectieux. Cette génération 2 est ainsi compatible avec des allongements plus réduits (moins traumatisants) et plus fréquemment répétés donc plus proches d'une croissance physiologique.
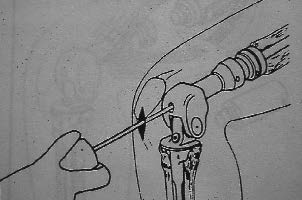
- Les éléments de croissance de troisième génération peuvent être actionnés sans incision par manoeuvre mécanique externe (figure 11) ou par stimulation électromagnétique (figure 12 et figure 13). L'absence de risques infectieux permet de fractionner l'allongement au maximum et de le répéter, au besoin, tous les 15 jours par séquences de 1 à 2 mm. L'absence de tout traumatisme musculaire évite les douleurs postopératoire, améliore considérablement la fonction du membre et permet d'espérer obtenir une croissance du membre non seulement en longueur mais également en épaisseur.
 |
 |
| Figure 10 : Schéma de l'allongement par arthroscopie d'une prothèse de croissance génération 2. |
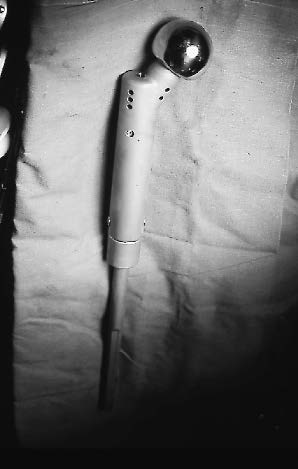
Figure 12 : Photographie du générateur d'ondes nécessaire pour stimuler les prothèses de croissance électromagnétiques de la génération 3. |
 |
 |
| Figure 11 : Photographie d'une prothèse de génération 3 par allongement mécanique. |
Figure 13 : Prothèse de croissance génération 3 à mécanisme électromagnétique. |
METHODES :
Dates de la pose de la prothèse de croissance :
Dix-huit malades ont bénéficié de la pose de la prothèse de croissance d'emblée, lors du geste de résection tumorale car la fabrication de la prothèse spéciale avait été commencée dès la biopsie réalisée par le chirurgien de l'équipe. Les neufs autres malades n'ont reçu de prothèses de croissance que secondairement, lorsque l'inégalité commençait à devenir préoccupante ou qu'une complication intercurrente (infections secondaires, descellement) ait obligé à enlever la prothèse initiale.
Dates des premiers allongements :
- Pour les prothèses nécessitant une réintervention sanglante, l'allongement de la prothèse est réalisé lorsque la différence de longueur entre les 2 membres est supérieure ou égale à 3 cm. Grâce à un système de cône morse au bout de la partie de croissance active, l'allongement de la prothèse n'a pas de limite et peut être supérieur à 15 cm même si la résection initiale était inférieure à cette taille.
- Pour les prothèses de génération 3, l'allongement est réalisé, le plus souvent possible, par paliers de 1 à 4 mm.
Gestes associés :
Dans huit cas, un lambeau musculo-cutané de protection utilisant, le plus souvent, le jumeau interne a été réalisé d'emblée ou secondairement.
COMPLICATIONS :
Les complications chirurgicales ont été fréquentes surtout avec les prothèses de génération 1 au début de notre expérience.
Les complications immédiates se résument à une ischémie aiguë secondaire à un allongement tibial trop important lors de la pose de la prothèse de croissance involontairement trop longue. Cette ischémie a régressé par la mise en flexion du genou mais a entraîné une paralysie du sciatique poplité externe gênant le malade pendant 18 mois.
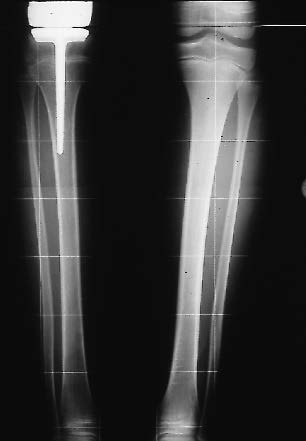
Les complications secondaires sont apparues au fil des allongements. La fibrose secondaire aux traumatismes répétés des parties molles touchent le tiers de patients, elle est responsable d'une raideur de genou gênant à la fois la fonction et les allongements ultérieurs. Elle a surtout été observée dans les prothèses de génération 1. Un descellement de prothèse de croissance tibiale avec impaction sur la diaphyse restante et perte d'allongement de 2 cm a été observé nécessitant un rescellement. Un descellement cotyloïdien suivi d'une luxation de prothèse de hanche (fémur entier avec croissance fémorale inférieure) a nécessité une reprise chirurgicale. Une fracture de la diaphyse tibiale a été observée (figure 15) au-dessous d'un élément de croissance passive du tibia.
Une stérilisation partielle de cartilage de conjugaison tibial (figure 16) par une prothèse aux ailerons latéraux trop important a entraîné un varus et nécessité une reprise avec élément de croissance passive longue queue ; cette reprise a été efficace au prix d'une parésie sciatique transitoire.
Une autre paralysie sciatique transitoire a été observée lors d'un changement de prothèse initialement posé de manière erronée (modèle droit sur un genou gauche) ayant entraîné un varus.
Mais la complication secondaire la plus grave est l'infection. Quatre patients ont, malheureusement, présenté une infection secondaire à un allongement. Dans tous les cas nous avons été obligé d'enlever la prothèse pour traiter l'infection avant de tenter une nouvelle repose de prothèse de croissance. Un malade a, finalement, été amputé. Deux malades ont bénéficié d'un nouvel allongement de leur prothèse de croissance. Le dernier malade est en attente d'allongement. La fréquence considérable (15%) et la gravité des complications infectieuses constituent le meilleur argument pour les prothèses de génération 2 et 3.
 |
 |
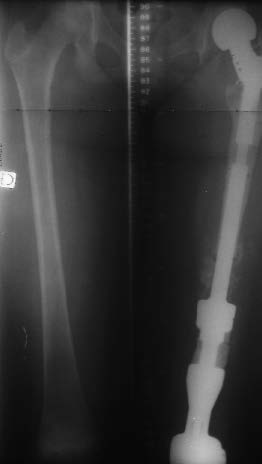 |
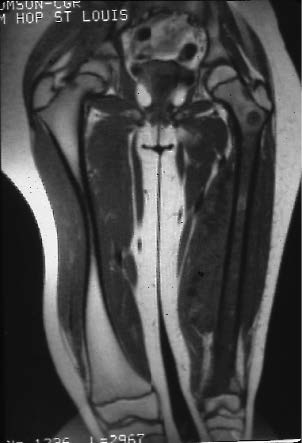
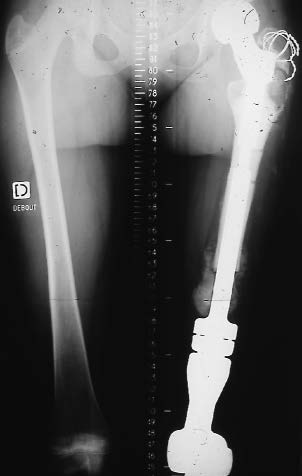
| Figure 14A : Volumineux sarcome d'Ewing du fémur gauche d'omblée métartatique aux poumons. |
Figure 14B : Ablation totale du fémur, reconstruction par prothèse du fémur entier comportant une prothèse de croissance. |
Figure 14C : 5 ans plus tard. Allongement de 5 ans. |
 |
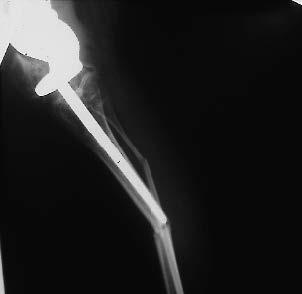 |
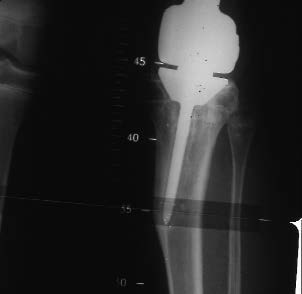 |
| Figure 14D : Aspect morphologique de l'enfant. |
Figure 15 : Fracture de la diaphyse tibiale au dessous d'un élément tibial standard d'une prothèse de croissance fémorale inférieure. Cette fracture a été traitée par changement de prothèse tibiale (enclouage par la longue queue tibiale du nouvel élément tibial). |
Figure 16 : Stérilisation partielle du cartilage de conjugaison tibial par un élément tibial aux ailerons trop profonds. Varus résiduel ayant imposé un changement d'élément tibial pour un tibia à longue queue non cimenté. Varus récupéré depuis. |
RESULTATS :
Résultats cancérologiques :
Cinq patients sont décédés de la maladie. Un malade est en traitement avec une maladie évolutive. Les 21 autres patients sont en première rémission complète.
Résultats orthopédiques :
Vingt et un patients ont pu bénéficier d'un allongement de la prothèse. La longueur moyenne de l'allongement est de 6,2 cm (minimum 2,4 cm ; maximum 12 cm). La fonction a été très améliorée par l'égalisation des membres inférieurs. En 1995, seulement 3 patients avaient reçu une prothèse d'adulte. Suivant les critères de l'EMSOS (Tableau 1 et 2), les résultats fonctionnels ont été classés en excellents ou très bons dans 15 cas, moyens dans 7 cas, et mauvais dans 5 (incluant l'amputation de cuisse).
LIMITES DU PROCEDE :
- 1 - Il faut souligner qu'avec les prothèses de génération 1 (les seules qui disposent actuellement d'un recul suffisant pour évaluer les résultats fonctionnels et morphologiques) la longueur du membre était certes obtenue mais avec un membre gracile et une amyotrophie résiduelle. Ces séquelles trophiques nous paraissent secondaires à la brutalité des allongements réalisés.
- 2 - Jusqu'à présent aucune rupture de matériel n'a été observée ni aucune métallose importante due au mécanisme d'allongement des prothèses de génération 1 et 2.
- 3 - Par contre les prothèses de génération 3 ont été sources de complications mécaniques sérieuses : Deux se sont allongées de manière incontrôlées, trois ont refusé de répondre aux stimulations électromagnétiques et une s'est rompue après allongement.
CONCLUSION :
Dans notre expérience, la prothèse de croissance est une alternative efficace à l'amputation chez les enfants jeunes. Néanmoins pour les prothèses de génération 1, le nombre d'interventions nécessaires et le risque d'infection lié aux réinterventions nous ont conduit à développer de nouvelles prothèses ne nécessitant plus d'abord large pour l'allongement. Nous espérons que les nouveaux modèles (génération 2), diminuant le risque infectieux, permettront en outre de simuler une croissance douce quasi physiologique et donc d'aboutir à des membres non seulement égaux en longueur mais également de meilleures trophicités. Pour les prothèses de génération 3 électromagnétiques, le prix élevé du matériel, la nécessité d'utiliser, lors de l'allongement un générateur d'onde lourd, coûteux, actuellement unique et la fiabilité encore insuffisante des prothèses, font que ce type expérimental de matériel doit être pour l'instant, réservé aux équipes au recrutement suffisant pour l'évaluer. Une prothèse de croissance ne peut, en effet, être définitivement jugée qu'à la fin de celle-ci c'est à dire au minimum 10 ans après sa pose.


