INFECTION APRES CHIRURGIE CONSERVATRICE PAR PROTHESE MASSIVE.
ETIOLOGIE ET TRAITEMENT.
Gérard DELEPINE, Nicole DELEPINE
Cette publication a été réalisé dans "Prothèses de reconstruction pour tumeurs osseuses".
Pages 63 à 70 - 8ème Séminaire P.E.R.F.E.C.T.O. - 8 mars 1996
INTRODUCTION
Depuis l'essor de la chirurgie conservatrice, les complications infectieuses, malheureusement trop fréquentes, se sont révélées les plus graves. Elles représentent encore actuellement la principale cause des amputations secondaires. C'est pour préciser les circonstances d'apparition, leurs traitements préventifs et les possibilités de traitement curatif que nous avons entrepris cette étude.
MATERIEL ET METHODES
De 1983 à 1995, nous avons opéré environ 450 sarcomes osseux, de toute localisation. Parmi ceux-ci, 246 ont nécessité une reconstruction par prothèse massive ou prothèse longue queue enrobée d'une allogreffe de banque et ont pu être suivis au moins 6 mois. L'âge moyen des malades est de 24 ans (minimal : 4 ans et demi; maximal : 82 ans). Il s'agissait d'hommes dans 62% des cas. L'étiologie du cancer primitif était un ostéosarcome dans 141 cas, un sarcome d'Ewing dans 39 cas, un chondrosarcome dans 38 cas, un histiocytome malin dans 15 cas et un fibrosarcome dans 8.
Cinq tumeurs à cellules géantes bénignes mais ayant récidivées à multiples reprises ou ayant détruit toute l'épiphyse complètent la série. Les topographies tumorales ont été dominées par le fémur (153 cas), le tibia supérieur (50 cas), l'humérus supérieur (27 cas). On note également 13 localisations péricotyloïdiennes ayant imposé une prothèse de bassin et 3 localisations scapulaires ayant nécessité une prothèse d'humérus massive.
Tous les malades ont été opérés par le même opérateur soit en milieu hospitalier (Hôpital Henri Mondor et pour quelques cas Hôpital Robert Debré), soit en clinique privée sans que la technique opératoire ou les matériels utilisés ne différent.
Les traitements complémentaires ont comporté de la chimiothérapie dans tous les sarcomes de degré histologique élevé : ostéosarcome (classique, télangectasique, anaplasique, ostéoplastique... à l'exclusion des ostéosarcomes juxtacorticaux), sarcomes d'Ewing, chondrosarcomes mésenchymateux, chondrosarcomes de degré 3 et chondrosarcome dédifférencié. La prédominance étiologique des ostéosarcomes et des sarcomes d'Ewing explique que les 3/4 de nos malades aient reçu une chimiothérapie lourde.
La radiothérapie a été adaptée au degré histologique de la tumeur, à sa sensibilité prévue, mais également à l'efficacité de la chimiothérapie préopératoire lorsque cette chimiothérapie était indispensable. En pratique la radiothérapie a été utilisée surtout au début de notre expérience (années 1980-1985) lorsque nous n'étions pas sûrs, par les chimiothérapies postopératoires, de rattraper les malades mauvais répondeurs.
De la même manière, des gestes de chirurgie complémentaires (plastique) ont été progressivement ajoutés aux interventions afin d'améliorer la couverture musculaire de nos prothèses. Ce geste est maintenant systématique, après résection de l'extrémité supérieure du tibia depuis 1986. Et pour l'extrémité inférieure du fémur lorsque la tumeur est très volumineuse depuis 1996.
Les malades ont été suivis conjointement par leur chimiothérapeute ou leur radiothérapeute et par le chirurgien de l'équipe. Le bilan standard comprend un scanner thoracique, une scintigraphie osseuse corps entier, des radiographies locales et un scanner local. Une IRM ou une angiographie ont été pratiquée en cas de doute de récidive locale.
N'ont été considérées dans cette étude que des infections certaines prouvées bactériologiquement. Notre étude ne peut donc que minorer le taux réel des infections. Le but étant de considérer le risque et le traitement des infections graves.
RESULTAT
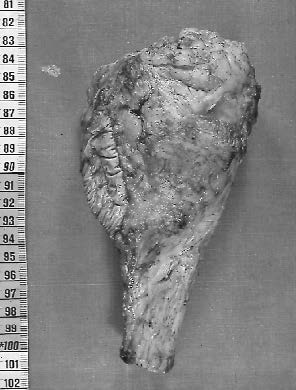
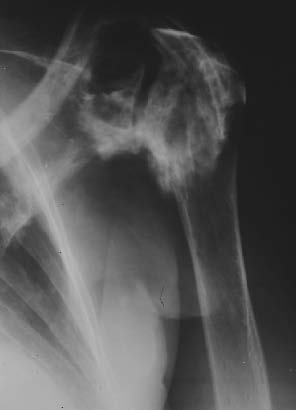
Avec un recul moyen de 5 ans et demi, 26 infections ont été observées (figures 1 et 2), soit dans plus de 10% des cas. Leur date d'apparition est variable. Un peu moins d'un quart (6) sont des infections précoces ; En dehors d'un cas d'infection évoquant une infection préopératoire sans cause favorisante, ces infections précoces ont toutes été secondaires à des nécroses cutanées extensives liées en règle générale au caractère particulièrement volumineux des tumeurs dont on avait essayé de sauver le membre (figures 3a et 3b).
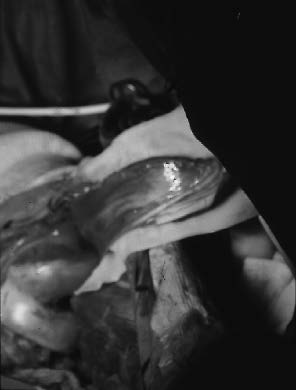
Neuf infections secondaires ont été observées (figures 4a, 4b, 4cet 4d), la plupart secondaires au traitement adjuvant (aplasie grave devenue fébrile précédant la localisation infectieuse locale) ou la radiothérapie.
Onze infections sont enfin survenues tardivement, soit inopinément sans reprise chirurgicale (1 cas d'infection survenu 10 ans après la prothèse massive, à l'occasion d'une angine), soit et surtout après reprise nécessitée par une complication orthopédique non infectieuse : Descellement, usure de bagues métalliques, allongement de prothèses de croissance. Les reprises chirurgicales représentent donc la cause majeure des complications infectieuses tardives.
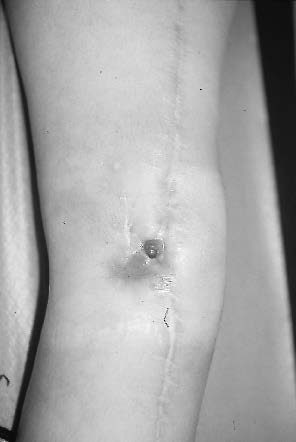
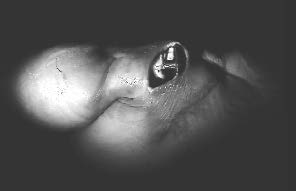
Figure 1 : Infection d'une prothèse massive du fémur inférieur posée pour ostéosarcome. L'infection est apparue en cours de chimiothérapie. Malgré un nettoyage, elle aboutie à une fistule chronique. |

Figure 2 : Infection apparue une prothèse massive du tibia non recouverte par un lambeau de jumeau interne.
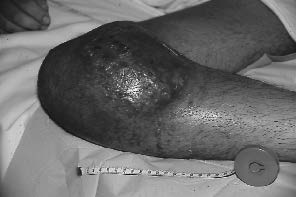
Figure 3a : Très volumineux ostéosarcone du tibia blocant l'articulation du genou en flexion et menaçant l'aponécrose |
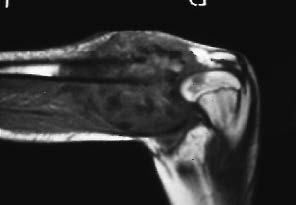
Figure 3b : Examen IRM du même malade montrant que la tumeur envahie l'articulation. On est alors obligé de faire une résection à la fois du tibia et du fémur inférieur sur 6 cm. |

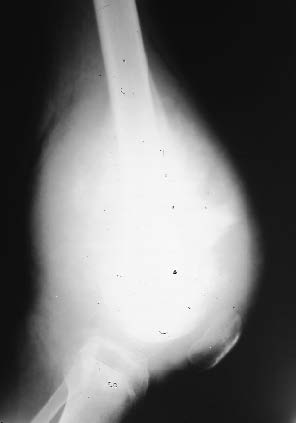
Figure 4a : Très volumineux ostéosarcome un fémur inférieur. Cliché avant chimiothérapie. |
 |
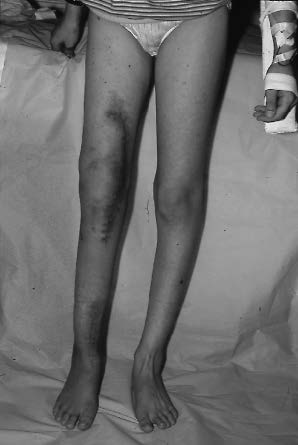 |
| Figure 4b : Même malade que la figure 3a. Scanner montrant l'énorme masse tumorale envahissant dans la quasi totalité des loges musculaires du genou. |
Figure 4c : Résection monobloc extra-tumorale avec reconstruction par une prothèse massive. |
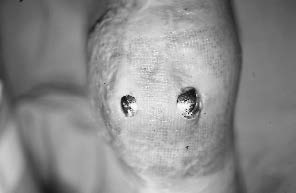 |
| Figure 4d : Cinq ans après, évolution spontanée avec nécrose cutanée sur les bords de la prothèse et apparition de la prothèse à la peau. |
DEVENIR DE L'INFECTION
L'infection profonde est toujours une complication grave pour la conservation du membre. Si l'on considère nos 26 infections primitives et 3 malades vus infectés après un traitement chirurgical comportant une prothèse massive pour tumeur, notre suivi de prothèses infectées porte sur 29 cas. De ces 29 cas, 3 ont dû être traités par amputation d'emblée (septicémie au cours d'une aplasie) et 10 secondairement après de multiples tentatives infructueuses de sauvetage du membre). Trois autres malades ont subi l'ablation définitive de la prothèse sans que l'on ait réussi à guérir l'infection. Les autres malades ont subi en moyennes 4 interventions et conservent actuellement un membre fonctionnel avec 1 prothèse en place, dont le résultat fonctionnel objectif et cependant bien inférieur au résultat habituel après prothèse non compliquée.
L'infection se révèle donc dans notre casuistique, la complication la plus grave après la récidive locale.
CIRCONSTANCES FAVORISANTES
L'analyse dossier par dossier et l'analyse statistique pour les topographies les plus fréquentes montrent le rôle étiologique des grosses tailles tumorales, des localisations tumorales distales, des thérapeutiques complémentaires, et des reprises chirurgicales pour des causes orthopédiques.
La topographie de la prothèse est directement liée aux risques infectieux. Ainsi, sur 50 tibias, nous avons observé 11 infections (22%) contre seulement 11 infections sur 153 localisations fémorales (7%) et une infection sur 27 humérus (3%). Les prothèses de bassin avec remplacement du cotyle ont également un taux d'infection très élevé (3 sur 13 , soit 13%). Cela est dû à la mauvaise vascularisation fréquente des lambeaux musculaires résiduels après ablation de tumeurs volumineuses péricotyloîdiennes. La topographie influence non seulement la fréquence de la complication infectieuse mais également son pronostic. Ainsi, les 11 prothèses de fémurs infectés n'ont abouti qu'à 4 imputations et le plus souvent non pas pour des échecs des guérisons d'infections mais pour des raisons impérieuses de survie (infections graves survenant en aplasie). Le taux d'amputation secondaire après infection des prothèses massives de fémurs est donc dans notre série que d'environ 33%. A l'opposé, les 11 infections tibiales ont abouti à 9 amputations. (82%). Cette prédominance des infections en cas de localisation périphérique est directement liée à l'épaisseur de la couche musculaire qui recouvre la prothèse. C'est ainsi que la fréquence des infections et le risque d'amputation en cas d'infection a été considérablement réduit depuis l'utilisation systématique d'un lambeau de jumeau interne selon la technique écrite par Jean Dubousset (figures 5a, 5b, 5c et5d). Depuis que la transposition du jumeau interne est pratiquée dans tous les cas de reconstruction tibiale supérieure, le taux d'infection dans cette localisation est devenu égal à celui observé dans les autres localisations osseuses.
Le rôle des thérapeutiques adjuvantes est évident à l'examen de nos dossiers. Quatre malades ont présenté le premier signe d'infection de prothèse uniquement après une septicémie lors d'une aplasie fébrile grave alors qu'ils avaient eu des suites simples et qu'ils se servaient tout à fait normalement de leur prothèse. La gravité de ces infections survenues en cours de chimiothérapie aplasiante doit être soulignée. Un seul malade (ostéosarcome du fémur supérieur) a pu conserver sa prothèse après un nettoyage, dépose, repose. Deux malades ont dû être amputés, le dernier a vu sa prothèse de bassin enlevée sans possibilité de repose pour ne pas risquer de retarder davantage la chimiothérapie. Ces infections survenant lors des aplasies sont également dramatique car il n'est pas question de retarder la chimiothérapie prévue par le protocole. Tout retard à la chimiothérapie postopératoire parait en effet susceptible de favoriser les métastases et ainsi d'aggraver le pronostic vital.
Le rôle de la radiothérapie ou de la radiothérapie associée à la chimiothérapie est également évident sur quelques dossiers, qu'il s'agisse de nécroses de la cicatrice sur l'ostéosarcome radio-induit (figures 6a, 6b, 6c et 6d), ou des cas où les nécroses sont apparues secondairement après la fin de la radiothérapie dans la zone irradiée.
 |
 |
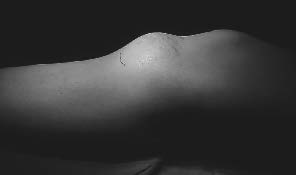
| Figure 5a : Très volumineux ostéosarcome du tibia supérieur soulevant la peau. |
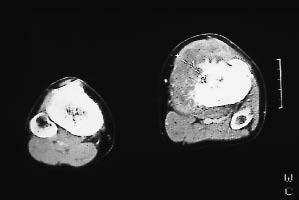
Figure 5b : Scanner du même malade que la figure précédente. La tumeur va sous la peau de toute la face antérieure et interne du tibia. |
 |
 |
| Figure 5c : Piède de disection monobloc avec la cicatrice de biopsie en surface. |
Figure 5d : Prévèlement du lambeau de jumeau interne selon la technique de Dubousset. Le lambeau est satisfaisant et permettra une bonne couverture de la prothèse. |
 |
 |
| Figure 6a : Ostésarcome postradique après cancer du sein datant de 10 ans. Pris pour une ostéonécrose simple. |
Figure 6b : Opéré par un orthopédiste avec mise en place d'une prothèse d'épaule banale. Diagnostic opératoire confirmant diagnostic d'ostéosarcome radique. Adressé dans le service pour reprise opératoire. |
 |
| Figure 5e : Lambeau en place recouvrant parfaitement la prothèse. Malgré cette énorme tumeur, les suites ont été simple et le malade bénéficie d'un membre utile indolore et satisfaisant 6 ans après la résection. |
Mais, la cause principale des infections réside dans les interventions itératives. Notre casuistique est marqué par 9 infections secondaires à 1 reprise non septique de prothèses massives pour descellement, allongement de prothèse ou fractures d'allogreffes. Ils'agit de malades qui ont terminé depuis longtemps leur chimiothérapie et leur radiothérapie. Lorsqu'ils n'ont eu qu'un traitement de chimiothérapie, le pronostic de l'infection profonde n'est pas mauvais ; au prix de réinterventions multiples, et en s'aidant de lambeaux de recouvrement, on parvient le plus souvent à sauver leurs membres. Au contraire, lorsque l'infection survient en milieu irradié, le pronostic est franchement mauvais : dans notre série, tous les malades ayant présenté une infection profonde en zone irradiée ont vu leur prothèse ou leur membre enlevés.
 |
 |
| Figure 6d : Nécrose cutanée due à la peau radique avec issue de la prothèse au travers la cicatrice. La prothèse devra être enlevée. Le malade est en rémission 4 ans après ces avatars chirurgicaux. |
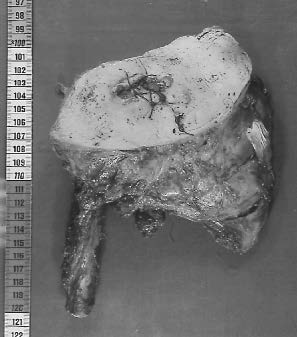
Figure 6c : Pièce de résection de la prothèse précédente et de tout l'omoplate d'ostéosarcome radique. L'exérèse est large et la peau est fermée malheureusement directement sur la prothèse sans lambeau possible, car les lambeaux régionnaux étaient irradiés. |
TRAITEMENT
L'infection d'une prothèse massive constitue la complication la plus sérieuse en dehors de la récidive locale.
Son traitement doit être avant tout préventif. Nous n'insisterons pas sur la nécessité des antibiotiques pré et postopératoires, ni des précautions d'asepsie rigoureuses qui sont évidentes pour tout orthopédiste.
Nous conseillons d'être très exigent sur la qualité de la couverture des prothèses après cette chirurgie en particulier à chaque fois que l'indication opératoire est "limite" c'est à dire sur une tumeur très volumineuse nécessitant des décollements cutanés important, il faut absolument voir quel lambeau musculaire est possible pour recouvrir au mieux le matériel posé.
Les lambeaux de jumeaux interne et plus rarement de jumeaux externe sont très commodes non seulement pour l'extrémité supérieure du tibia mais aussi pour l'extrémité inférieure du fémur. On ne dispose actuellement pas de lambeau simple pour les prothèses péricotyloïdienne et là réside certainement la prévention des nécroses et des infections consécutives.
L'aplasie est toujours une complication grave. Dès qu'elle est trop profonde et à plus forte raison lorsqu'elle devient fébrile, l'antibioprophylaxie est indispensable. L'emploi des facteurs de croissance médullaires stimulant la lignée granulocytaire est utile dans la mesure où elle permet de sortir plus rapidement des aplasies profondes.
L'emploi d'un matériel dont la longévité est la plus grande possible constitue également un bon moyen de prévention des infections puisque dans notre série, 40% des infections sont survenues secondairement à l'occasion d'une reprise pour complication orthopédique non infectieuse.
LE TRAITEMENT CURATIF
Le traitement d'une infection avérée est malheureusement particulièrement difficile et trop souvent décevant.
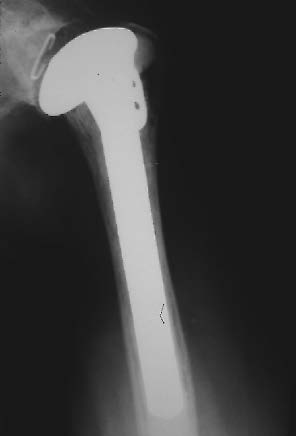
La première chose à faire est d'enlever la prothèse. Lors de cette ablation, il faut reconstituer une entretoise au ciment et un montage si possible solide pour qu'il ne puisse pas y avoir de raccourcissement du membre ou de déformation gênante (figure 7).
L'entretoise de ciment devra être suffisamment volumineuse (si possible plus volumineuse que la prothèse ultérieurement prévue) pour imposer systématiquement un lambeau musculaire si celui-ci n'avait pas été fait précédemment. Nous n'avons ainsi réussi à sauver des membres qu'au prix de lambeaux du droit antérieur sur le fémur inférieur ou de lambeau libre de grand dorsaux...
Le nettoyage dépose repose en un temps ne nous parait pas bien adapté aux prothèses massives même si elle donne parfois des résultats satisfaisants dans les prothèses ordinaires infectées. En effet, on n'est jamais certain d'obtenir l'asepsie totale dès le premier nettoyage. La surveillance postopératoires des redons est donc très utile. Lorsque le redon devient positif, il faut proposer un nouveau nettoyage. Ce n'est qu'après avoir obtenu une asepsie prouvée par les cultures que l'on peut proposer la repose d'une prothèse. Bien entendu, toute période postopératoire de dépose de prothèse doit être encadrée par une antibiothérapie double dirigée d'après l'antibiogramme et éventuellement aidée par les dosages sanguins des antibiotiques. Lorsque l'asepsie est obtenue, la repose pourra se faire dans les conditions habituelles en apportant là aussi un soin tout particulier à la vitalité de la couverture musculo-cutanée.
Au total, cette chirurgie est longue, difficile et incertaine mais des succès parfois inespéré sont possibles ainsi qu'en témoignent quelques unes de nos observations.
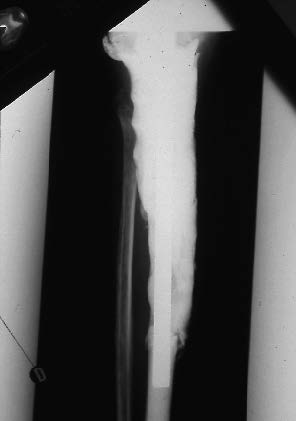 |
| Figure 7 : Exemple d'entretoise au ciment comportant des antibiotiques posés après exérèse d'une prothèse massive infectée. Les suites seront simples et permettrons de reposer une prothèse chez ce malade. |
CONCLUSION
L'infection profonde constitue la complication orthopédique la plus grave après chirurgie conservatrice utilisant une prothèse massive. Elle finit par imposer l'amputation dans près d'1 cas sur 2. Son traitement doit être avant tout préventif en recourant systématiquement aux lambeaux musculaires dans les zones où la couverture musculaire après exérèse est insuffisante, en limitant la durée des aplasies de chimiothérapie par les facteurs de croissance médullaires, et en cherchant à développer des matériels dont la durée de vie permet de réduire la fréquence des réinterventions orthopédiques malheureusement toujours nécessaire maintenant que l'on guérit ces enfants atteints de sarcomes osseux.


