Congrès éthique et médicament / Congrès de la chaîne des médicaments - 2008
Voir la version PDF de cette publication :

VIOXX - Chronique d'une catastrophe annoncée
Gérard Delépine,
Nicole Delépine
VIOXX - Chronique d'une catastrophe annoncée
Les leçons que l'on peut en tirer
Document présenté au congrès éthique et médicament de l'unité d'oncologie de Garches, Hôpital Raymond Poincaré en Juin 2007 puis au congrès de la chaîne des médicaments de Montréal sous l'égide du GEIRSO en Septembre 2007
1999 autorisation de mise sur le marché
Présenté comme une molécule révolutionnaire le Vioxx est autorisé aux États-Unis et prescrit aux patients souffrant d'arthrose.
Cette AMM avait été délivrée en 6 mois
(AMM = Autorisation de Mise sur le Marché)
November 23, 1998: Merck soumet son produit au New Drug Application (NDA) de la FDA.
April 20, 1999: le "Advisory Committee on Arthritis Drugs" se réunit pour débattre du dossier.
May 20, 1999: The FDA approuve l'AMM du Vioxx pour le traitement des douleurs violentes de l'adulte et des signes et symptômes de l'arthrose.
D'après le Center for Medicines Research International, la FDA met en moyenne 1.3 an pour approuver une nouvelle drogue, contre 1.4 en Europe et 1,6 au Japon.
Pourtant il existait de sérieux doutes sur le Vioxx avant son AMM en 1999
"En 1998, Dr. Doug Watson, un scientifique de Merck, a présenté une analyse rapportant plus de complications cardiaques avec le Vioxx qu'avec d'autres produits Merck".
Cette analyse concluait que les hommes avec Vioxx avait un risque accru de 28 % mais que chez les femmes, le risque était multiplié par plus de deux (216 %, statistiquement
significatif).
Dr Singh : "A ma connaissance ces données n'ont jamais été publiées".
Il existait vraiment des doutes sur le Vioxx avant son AMM
En 1999 un scientifique de la FDA remarquait que "les accidents thromboemboliques [such as heart attack and stroke] sont statistiquement plus fréquents avec le Vioxx qu'avec les placebos".
Résumé des études VIGOR et GLASS
(VIGOR : Vioxx Gastrointestinal Outcomes Research)
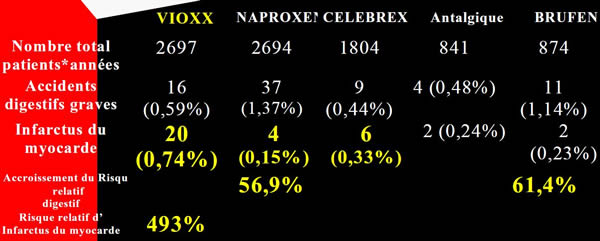
Dans l'étude VIGOR le vioxx exposait à un risque cardiaque 5 fois supérieur à celui du naproxène.
Que fit MERCK ?
Merck décida de ne pas faire d'études complémentaires pour préciser les causes de cet excès d'accidents cardiaques. C'est pourtant le type d'étude que tout scientifique indépendant aurait prioritairement mené devant un risque cardiovasculaire aussi important (*5). Il ne fallait pas risquer de ternir la réputation du vioxx.
Pour présenter au mieux le Vioxx
La compagnie a manipulé les résultats et les conclusions de sa principale étude appelée VIGOR. L'excès d'accidents cardiaques observés avec le vioxx fut attribué à un effet protecteur du naproxen plutôt qu'à un effet toxique du vioxx. Et minoré dans l'article adressé au New England Journal of Medecine.
Que fit la FDA?
Au lieu de demander une nouvelle étude la FDA a donné très rapidement l'AMM.
La mise sur le marché ne présentait pourtant aucun caractère d'urgence. Il existait déjà de nombreuses drogues qui remplissaient la même fonction: calmer l'inflammation sans
trop grand risque gastrique.
La FDA ne demanda même pas que mention du risque cardiaque soit faite dans la notice
d'usage initiale (corrigée en 2002).
Le Vioxx fut un modèle de marketing
Tout d'abord une campagne de lancement gigantesque précédée de "fuites" dans la presse grand public si bien que les professionnels ont souvent été informés après les patients et fortement incités à prescrire par ces mêmes patients.
Une campagne de lancement gigantesque
Merck monte une intense campagne de promotion et inonde les magazines de publicités vantant les vertus de son produit miracle.
Le Vioxx est "en passe de révolutionner la pratique des anti-inflammatoires, tout en évitant les effets désagréables sur l'estomac."
Une campagne de promotion sans précédent à la télévision
In 2000, Merck a dépensé 160.8 millions de $ pour des publicités télévisuelles destinées
aux consommateurs. La population a été accoutumée aux pub télé Vioxx mettant en
scène la star de skate Dorothy Hamill.
Sid Wolfe, médecin et directeur du Health Research Group of the advocacy group Public
Citizen in Washington souligne "Dorothy Hamill ne dit pas aux gens qu'avec le Vioxx ils ont un risque cardiaque multiplié par 4."
Début 2000 Merck attaque le marché français
"La rumeur de l'arrivée d'un médicament qui allait révolutionner le traitement de
l'arthrose et mettre les gastroentérologues au chômage a précédé son autorisation de
mise sur le marché".
Il n'y a pas un jour sans qu'un article dans la presse féminine et généraliste ne vante les
mérites du médicament de Merck.
Merck a déployé l'artillerie lourde
Les pontes de la rhumatologie ont signé tribune sur tribune dans les magazines spécialisés pour promouvoir l'innovation thérapeutique.
Une armada de visiteurs médicaux a sillonné l'Hexagone, cadeaux en poche, pour vendre le Vioxx aux médecins.
Trois jours avant sa mise sur le marché le laboratoire a réalisé la promotion de son
produit, en sponsorisant largement le congrès annuel de la Société française de rhumatologie.
L'orchestration de l'arrivée du Vioxx est un modèle du genre
Note Yves Bur, vice-président UMP de l'Assemblée nationale et président du groupe d'études sur le médicament.
Merck a suscité l'attente et créé le besoin, si bien que les médecins refusant d'en prescrire passaient pour des ringards...
Dès la mise sur le marché du Vioxx
Les patients se ruent chez leurs médecins pour qu'on leur prescrive ce nouveau médicament dont la presse s'est tant fait l'écho.
Une fois le public conditionné, Merck peut passer à la phase deux de sa stratégie :
imposer un prix de vente élevé et obtenir des pouvoirs publics un haut niveau de
remboursement. Car, fait rarissime, le groupe a commercialisé le Vioxx avant d'avoir conclu les négociations et après avoir fixé lui-même les tarifs.
Un prix multiplié par 3 à 5 !
Coût quotidiens des traitements au Canada

En France la boîte de 28 comprimés se vendait près de 40 euros, soit deux à trois fois le prix des autres anti-inflammatoires disponibles.
Pourtant dès l'été 2000 La revue française Prescrire indiquait
Juillet-Août 2000 N° 208- Tome 20 - Pages 481-560
ACTUALITES MEDICAMENTS :
- Le VIOXX (rofécoxib) un antalgique AINS décevant.
- Vioxx n'apporte "rien de nouveau".
- Ses essais cliniques sont "imprécis".
- Il reste des "questions sans réponse", notamment sur ses effets cardiaques.
En 2001 ce magazine indépendant pronostiquait même un futur retrait du Vioxx.
Un succès financier planétaire
Le Vioxx a été utilisé par plus de deux millions de personnes dans plus de 80 pays.
En France, 500 000 malades en ont pris régulièrement, et il est devenu le dixième médicament le plus remboursé en 2003 (pour un montant de 87 millions d'euros), avec 8 % du marché des anti-inflammatoires.
Il rapportait 2.5 milliards de $ par an.
Élargir les indications
Ensuite les dirigeants de Merck décidèrent de conduire d'autres essais cliniques visant à élargir les indications de leur produit vedette à d'autres maladies.
Ainsi ils le proposèrent pour prévenir la dégénérescence des polypes coliques...
Mais vouloir augmenter les indications présente des risques!
L'étude sur la prévention par le Vioxx de la dégénérescence des polypes coliques confirmait un risque cardiaque trop élevé.
Une complication cardio vasculaire grave a été observée chez 16 des 685 patients 2,3%) qui ont été traités par 200 mg de Vioxx deux fois par jour contre 7 des 679
patients du groupe placebo (1.0 %).
Cardiovascular risk associated with celecoxib in a clinical trial for adenoma prevention Solomon SD et coll
Septembre 2004 Merks retire le Vioxx du marché.
N'ayant pas réussi à empêcher la publication de l'article de Salomon, compte tenu de la diffusion des informations sur les risques cardiaques du produit, les analystes financiers du groupe avaient jugé la poursuite de la commercialisation potentiellement ruineuse.
18 Août 2005 : 1er verdict
Le tribunal fédéral d'Angleton, au sud de Houston (Texas, sud), a condamné Merck à verser plus de 250 millions de dollars à madame Ernst, veuve d'un homme qui avait pris du Vioxx.
La condamnation a été prononcée pour vente d'un produit défectueux, négligence et malveillance.
17 Novembre 2005 : Témoignage du docteur D.Graham
Associate director for science and medicine at the FDA's Office of Drug Safety.
Ce témoignage a été fait sous serment devant le comité sénatorial des finances érigé en commission d'enquête le 17 novembre 2005.
Il a mis en evidence que Merck et la Food and Drug Administration (FDA) avaient connaissance des risques du Vioxx des années avant son retrait du marché.
Témoignage du docteur D.Graham : nombre de victimes
"Durant l'été 2004 l'étude que j'ai menée a conclu que le Vioxx était responsable d'environ 38 000 attaques cardiaques et morts subites."
"cette estimation constitue un minimum".
"a more realistic and likely range of estimates for the number of excess cases in the US" was between 88,000 and 139,000. Of these, 30-40 percent probably died. For the
survivors, their lives were changed forever."
"Le nombre de victimes du vioxx excède considérablement celui des 500 enfants américains victimes d'un sirop de sulfanilamide dans les années 1930 et des 5 000 à 10 000 enfants nés dans les années 1960's avec des malformations dues à la thalidomide.
Chacune de ces catastrophes a entraîné des modifications des agences de régulation."
8 Décembre 2005 : Tribune du New England Journal of Medicine
Dans une tribune du New England Journal of Medicine, le Dr. Gregory Curfman, rédacteur
en chef du journal ainsi que trois autres médecins affirment que Merck, qui produit l'anti-inflammatoire Vioxx a dissimulé trois accidents cardiovasculaires dans une étude clinique VIGOR publiée en 2000 dans la revue médicale.
Les éditeurs avaient trouvé un tableau vierge intitulé "CV events" - heart attacks and other cardiovascular side effects - sur une disquette présentant une première version de l'étude VIGOR.
Ce tableau a été effacé de la version finale.
Le Dr. Gregory Curfman, a confirmé que le software a indiqué que les données ont été
effacées deux jours avant la remise du manuscrit et que l'auteur de l'effacement des
données était "Merck."
Les rédacteurs de cette tribune précisent aussi que les auteurs de l'étude en question ont également effacé d'autres données importantes avant de la soumettre à publication : "Ces inexactitudes et les informations dissimulées remettent en question l'intégrité de ces données médicales sur (la fréquence) des accidents cardiovasculaires (liés au Vioxx) dont fait part cette étude".
La connaissance de ces cas aurait changé les conclusions de l'étude sur la toxicité, montrant que les patients sous vioxx avaient non pas 4 mais 5 fois plus de risque d'accidents cardiaques que les patients sous naproxène, et que des patients sans risque
particuliers étaient également menacés d'attaque cardiaque.
"Globalement ces imprécisions et ces dissimulations remettent en question la validité des données."
Les responsables du journal n'ont pas compris les implications de cette découverte avant le 21 Novembre 2005, lorsque Curfman a été interrogé par les avocats de
Plunkett's qui lui ont monté un memo prouvant qu'au moins deux auteurs connaissaient le risque cardiaque réel au minimum deux semaines avant l'envoi du manuscrit et 4 1/2 mois avant la publication.
Jusqu'à cette date les éditeurs croyaient que les auteurs n'avaient eu connaissance du nombre exact d'accidents cardiaques qu'après la publication.
Les éditeurs du journal ont admis que les données présentées par les chercheurs de Merck ont été acceptées trop facilement et qu'elles auraient du être discutées davantage.
Curfman a reconnu qu'en plus des conclusions des auteurs il aurait du élever l'hypothèse de la toxicité du vioxx : "Je crois que j'aurais dû être plus critique à l'époque et que j'aurais dû davantage rechercher d'autres hypothèses."
17 Août 2006 : Nouveau procès
Dans un nouveau procès le verdict a condamné Merck & Co à payer 50 millions de $ de dommages à un ancien agent du FBI qui a souffert d'attaque cardiaque après avoir pris du Vioxx.
Procès Vioxx de 2007
Le 1er procès de 2007 a vu un jury unanime déclarer que Merck a commis un délit en trompant intentionnellement la communauté médicale en cachant des informations
cruciales sur le Vioxx.
Les jurés ont fixés les dommages à $47.500.000.
12 Mars 2007 : Jugement en appel
Dans un cas de crise cardiaque d'un ouvrier des postes de l'Idaho, un jury de New Jersey statuant en appel a reconnu la responsabilité du Vioxx dans la mort du plaignant.
Ceci a renversé le verdict original, et le jury a attribué au plaignant 20 millions de $ de
dommages. Le jury décidera maintenant si Merck devra payer des dommages punitifs en plus des $20 millions de dommages réels.
Risque financier des procès
- Merck a provisionné 970 millions de $ pour les frais de justice, et indiqué qu'il en a dépensé 285 millions en 2006.
- Les 685 millions restants devraient couvrir les dépenses jusqu'en 2007.
- Sur les 14 procès qui ont été déjà instruits et se sont terminés sur un verdict, le groupe en a gagné neuf et en a perdu cinq.
2007 même les actionnaires...
La cour fédérale jugeant une plainte des actionnaires accusant Merck d'avoir caché des informations sur son produit a conclu qu'il existait une évidence de fraude au minimum
depuis 2001, plus de 3 ans avant le retrait du produit du marché.
Les fautes du laboratoire sont nombreuses :
- Dissimulation des effets dangereux.
- Manipulation des données.
- Falsification des données et des conclusions.
- Intimidation des témoins.
- Campagne de calomnie des opposants.
- Collusion avec la FDA.
Dissimulation d'études négatives
Un ancien chef du service de recherche de Merck Dr. Edward Scolnick a témoigné dans
un procès Vioxx en Californie que "la compagnie n'a pas informé la FDA de deux études montrant que les patients sous Vioxx avaient un risque de mort plus élevé que ceux sous placebo."
Merck a aussi tenté en vain d'empêcher la publication de l'étude de Salomon sur les
complications du Vioxx.
Intimidation des opposants
New England Journal of Medicine
Le journal précise que Merck a cherché à intimider les médecins qui posaient des questions sur les risques du Vioxx.
Un professeur de l'université Stanford, Gurkirpal Singh, reprochait à Merck de ne pas avoir fournit davantage de données sur les risques cardio vasculaire du Vioxx.
En Octobre 2000, Lois Sherwood, cadre supérieur de Merck a appelé James Fries, un
autre professeur de Stanford University Medical School pour se plaindre que les discours du Dr. Singh étaient irresponsables, anti-Merck et spécifiquement anti-Vioxx...
Témoignage du Dr. Fries :
Le responsable de Merck menaçait que si les choses continuaient ainsi, le "Dr. Singh
serait 'grillé' et qu'il y aurait des conséquences pour moi et pour Stanford".
Le Dr. Fries complète "les chercheurs d'autres universités ont également fait état d'une
attitude d'intimidation permanente des chercheurs par Merck".
(Témoignage du Dr. Fries en Janvier 2001 dans une lettre adressée à Mr. Raymond Gilmartern, the Merck chief executive.)
In 2002, Un institut espagnol a vu ses crédits supprimés par Merck après son refus de
censurer les critiques d'un de ses scientifiques envers le laboratoire.
Décembre 2005 Cleveland Clinic. Le Dr. Eric Topol, cardiologue réputé et critique des
prescriptions de Vioxx, a été chassé de son poste de professeur chef de service après un témoignage sur le Vioxx devant une cour fédérale.
L'insuffisance de la FDA est patente
- Aucune critique du dossier VIGOR.
- Acceptation de l'explication Naprosène.
- AMM "pony express".
- Refus de communiquer le dossier Vioxx.
- Collusion avec Merck.
- Campagne de dénigrement d'un de ses employé.
La FDA a été au mieux inefficace, au pire complice
Elle a accepté sans discuter l'explication de Merck sur l'excès d'accidents cardiaques de
l'étude VIGOR pourtant d'après un mémo de la FDA daté du 30 Septembre 2004 "pour expliquer une telle différence il aurait fallu que le Naproxène soit un cardio protecteur
particulièrement puissant et efficace","il n'existe aucun indice que ce soit le cas".
Témoignage du docteur D.Graham : Inefficacité de la FDA
Graham a expliqué que "l'OND qui occupe une position hiérarchique plus élevée que l'ODS est très réticent a promulguer des restrictions d'emploi des drogues déjà sur le
marché et encore plus réticent à en retirer une. Dans le cas du Vioxx, c'est le laboratoire et non pas l'OND qui a pris la décision de retrait " devant les conséquences financières désastrueuses prévisibles.
An editorial in The Lancet
An editorial in The Lancet notes that the paper demonstrates "The unacceptable cardiovascular risks of Vioxx (rofecoxib) were evident as early as 2000.
A full 4 years before the drug was finally withdrawn from the market by its manufacturer, Merck.
La FDA n'a pas collaboré à l'enquête
Des poursuites ont du être diligentées contre la FDA pour obliger l'agence à communiquer les données du dossier Merck traitant du marketing et des études de sécurité sanitaire du Vioxx.
En effet les demandes formelles de communication de ces documents par la FDA ont été ignorées ou reçues des réponses dilatoires pendant 3 ans.
Insuffisance de la DFA
D'après Graham "des études indépendantes sont exceptionnellement réalisées par la
FDA, et les problèmes concernant la sécurité sont ignorés ou délibérément sous estimés."
Témoignage du docteur D.Graham : Collusion la FDA et big pharma
L'OND est la branche de la FDA la plus proche des compagnies pharmaceutiques qu'il est censé contrôler.
Depuis 1992 et la promulgation du "Prescription Drug User Fee Act" l'OND reçoit la majorité de ses crédits de fonctionnement des compagnies pharmaceutiques, sous la forme de demande d'AMM (500,000$ par demande).
Trop souvent la FDA considère et continue de considérer l'industrie pharmaceutique comme son client "une source vitale de revenus pour son existence et non pas un secteur d'activité de la société qui nécessite une régulation sans faille."
Témoignage du docteur D.Graham : Collusion entre Merck et la FDA
The ODS, responsable de la sécurité des médicaments mis sur le marché américain, fait partie du Centre d'Évaluation et de Recherche (CDER), qui regroupe également l'Office des Nouveaux médicaments (OND), responsable des autorisations de mise sur le marché américain.
Graham a expliqué comment il est entré en conflits répétés avec l'OND lorsqu'il a voulu
soulever le problème des risques du Vioxx.
Lorsqu'il se préparait à publier ses données, il fut attaqué par l'OND et d'autres à la FDA.
"I was pressured to change my conclusions and recommandations, and basically threatened that if I did not change them, I would not be permitted to present".
"An email from the director for the entire OND was revealing. He suggested that since FDA was 'not contemplating' a warning against the use of highdose Vioxx, my conclusions should be changed."
Calomnies contre le donneur d'alerte
Deux mois après le témoignage de Graham devant la commission d'enquête du sénat la FDA a défendu son point de vue sur le Vioxx.
Plus tard un officiel de la FDA a qualifié les travaux de Graham comme "junk science" (science de caniveau).
Collusion entre Merck et la FDA
Le Sénateur Charles Grassley, de l'Iowa, a demandé à l'"inspector general at the Health and Human Services Department" d'établir si la FDA et Mercks s'étaient concertés pour discréditer les recherches sur les risques du vioxx faites par le Dr. David Graham.
Le sénateur Grassley a cité les notes manuscrites d'un employé de Merck datées du 13 Octobre 2004 faisant état d'une conversation avec un représentant de la FDA suggérant une collaboration entre les deux pour discréditer Graham.
Les notes établissent que le représentant de la FDA mentionnait une "opportunité de
détruire le message" (de Graham), et la possibilité de "donner aux journalistes une
critique maison" (de Graham).
Les notes du Sénateur Charles Grassley, R-Iowa montrent que la FDA a aidé Merck a récuser les travaux de Graham. Ainsi Dr. Brian Harvey (FDA) a suggéré au Dr. Ned Braunstein (Merck) "an official rebuttal on Graham" selon les notes qui ont été admises comme preuve, dans un procès fédéral.
Des e-mails envoyés par la FDA et vus par The Associated Press montrent que cette agence avertissait Merck des détails sur la présentation que Graham devait faire en France en Août 2004 sur les dangers du Vioxx.
Ces e-mails suggèrent qu'une telle collusion est habituelle.
"Ce n'est un secret pour personne que le Dr. Graham a une position critique sur la FDA. Cependant cela ne justifie pas que la FDA aide à discréditer ses employés" précise Grassley dans une lettre à l'Inspecteur Général Daniel Levinson. La FDA, doit maintenir une "séparation claire et nette entre le régulateur et le régulé."
Insuffisance des organismes de contrôle
The FDA and MRHA sont les deux organismes mondiaux les plus importants chargés de l'évaluation des produits pharmaceutiques et leur réputation a beaucoup souffert.
Il faut qu'ils démontrent que leur premier souci est la protection du public et non pas celle de l'industrie pharmaceutique.
Les leçons de cette catastrophe
- L'intérêt des compagnies pharmaceutiques est en contradiction directe avec celui des
malades et des médecins qui veulent une information complète et sincère sur la nature
des produits qu'ils prescrivent ou qu'ils prennent.
- La pratique de certains laboratoires pharmaceutiques est très discutable.
- Les agences censées les contrôler sont inefficaces ou complices.
Le cas du Vioxx n'est pas isolé
- Ainsi l'Isoméride et le Pondéral ont été retirés en 1998.
- en 2000, le Rezullin (médicament contre le diabète) a été supprimé en raison d'alerte par la FDA au sujet de complications hépatiques.
- et en 2001 c'est le Baycol (commercialisé en France sous le nom de Staltor) qui est retiré en raison de suspicion au sujet de dizaines de décès et on peut aussi se poser des questions sur un "cousin du Vioxx" le Celebrex.
- la cerivastine (laboratoire BAYER) commercialisée en France sous les noms de "Staltor" et de "Cholstat", retirée du marché en 2001 après le décès de 52 patients.
- le crestor (laboratoire ASTRAZENEKA) mis en cause pour les mêmes effets indésirables.
- le Celebrex de PFIZER, soupçonné en France d'être à l'origine d'accidents vasculaires comparables.
Commentaires
Ces différentes affaires aux répercussions politiques et économiques incalculables, ont au moins deux éléments en commun, quel que soit le laboratoire concerné et le type de
molécule en cause :
- La dissimulation par les laboratoires d'études négatives.
- La singulière absence de réaction des autorités sanitaires.
La dissimulation par les laboratoires d'études négatives
Ainsi, la firme BAYER, selon un rapport d'expertise effectué à la demande d'un juge du pôle santé du TGI de Paris1(*), aurait délibérément voulu tromper les autorités sanitaires en minimisant les dangers constatés dès 1991 de la cerivastine, soit dix ans avant son retrait.
Il est de même établi que les risques liés à la prise d'antidépresseurs étaient connus des
laboratoires mais gardés secrets.
British Medical Journal 2004; 329 (27 November)
J'ai été surpris de découvrir à quel point les représentants du National Health Service considère l'industrie pharmaceutique comme la source de financement des recherches et développement et font peu état de la transparence, des conflits d'intérêts, et des relations troubles entre les laboratoires pharmaceutiques et les organismes de contrôle.
La singulière absence de réaction des autorités sanitaires
Les autorités sanitaires (FDA américaine, EMEA européenne, AFSSAPS française) se sont montrées incapables de jouer le rôle de contrepouvoirs indépendants par rapport à la puissance de l'industrie pharmaceutique.
Insuffisance des organismes de contrôle
Témoignage du docteur D.Graham
A la FDA, on pense généralement que l'industrie pharmaceutique grossit les avantages des nouvelles drogues et sous évalue leurs risques.
Quand au principe de sécurité, la FDA considère qu'une drogue est sûre à moins d'une preuve formelle de complication.
Les nouveaux produits tels que le Vioxx, sont mis sur le marché sans attendre des études sur leur sécurité.
Des tests cliniques indépendants sont rarement réalisés par la FDA, et les limitations d'emploi sont ignorées ou sous estimées.
Conclusion
"L'histoire du célécoxib est un exemple de l'insuffisance des agences du médicament européennes et américaine.
Le célécoxib est toujours sur le marché, des patients sont toujours exposés aux dangers d'un médicament qui n'apporte aucun progrès thérapeutique."
La revue Prescrire 1er juillet 2005; 25 (263) : 512-513
Les impératifs de santé publique nous imposent d'apporter une réponse claire à la question que tout le monde se pose :
Peut-on encore faire confiance aux agences qui ont pour mission d'évaluer la sécurité
d'emploi, l'efficacité et la qualité des produits de santé ?


