Document Nicole Delépine - 2011
Voir la version PDF de cette publication :

Conflits d'intérêts dans la chaîne du médicament
Nicole Delepine
Conflits d'intérêts dans la chaîne du médicament - Comment en sortir?
Définition :
"Un conflit d'intérêts naît d'une situation dans laquelle un agent public a un intérêt personnel de nature à influer ou paraître influer sur l'exercice impartial et objectif de ses fonctions officielles.
L'intérêt personnel de l'agent public englobe tout avantage pour lui-même ou elle-même ou en faveur de sa famille, de parents, d'amis ou de personnes proches, ou de personnes ou organisations avec lesquelles il ou elle a ou a eu des relations d'affaires ou politiques.
Il englobe également toute obligation financière ou civile à laquelle l'agent public est assujetti."
(Conseil de l'Europe, Recommandation n° R (2000)10 du Comité des ministres sur les codes de conduite pour les agents publics, 11 mai 2000).
Création des agences de régulation :
Depuis les premières catastrophes médicamenteuses (Sirop de Sulfamide, Thalidomide) les gouvernements des pays développés ont institué des systèmes de contrôle censés protéger leurs populations de la survenue de nouvelles catastrophes.
Food and Drug Administration aux USA.
AFSSAPS en France.
Schéma des systèmes de régulation :
Essais thérapeutiques.
Autorisation de mise sur le marché après évaluation bénéfice/risques.
Fixation du prix et du taux de remboursement.
Établissement de recommandations de bon usage : doses, durée de prescription, étendue des indications et des contre-indications du médicament.
Surveillance des médicaments après mise sur le marché (pharmacovigilance).
Recommandations de bon usage :
C'est l'AFSSAPS qui produit ces recommandations, parfois complétées par des standards, options et recommandations et les conférences de consensus réalisés par HAS.
Ces recommandations ont un effet direct sur les ventes.
65 à 91% des membres de l'AFSSAPS déclarent des liens d'intérêt avec l'industrie pharmaceutique).
Jadis les représentants de l'Etat : ne devaient pas percevoir une quelconque rémunération complémentaire à leur activité publique ou devaient passer devant une commission d'éthique pour en demander l'autorisation.
Après l'arrêt de leur activité publique, ils ne devaient pas travailler dans des sociétés qu'ils avaient auparavant contrôlées.
Ces dispositions dictées par l'expérience avaient pour but de garantir la neutralité de l'état et l'indépendance des décisions de ses représentants pour le bien commun.
Depuis la réforme libérale le mélange public-privé est devenu le dogme, multipliant les conflits d'intérêt.
Ces conflits d'intérêt entre médecins, chercheurs, experts et l'industrie corrompent tous les étages de la chaîne du médicament.
Ils culminent chez les leaders d'opinion et le personnel politique et administratif de premier rang (ministres d'un pays, décideurs de l'OMS, ou membres du comité Nobel...)
Émergence des Big Pharma :
La mondialisation a entraîné une concentration inégalée de l'industrie pharmaceutique
7 firmes contrôlent 80% des médicaments.
Leur budget dépasse celui de nombreux états.
20% à 30% de leur chiffre d'affaires est consacré à la promotion de leurs produits.
Puissance financière des Big Pharma :
Leurs bénéfices atteignent souvent 30% de leur chiffre d'affaires (vs 3% pour les pétroliers!).
Sanofi Aventis représente la 2ème capitalisation boursière à Paris.
Plus de 100 milliards $ annuels sont consacrés à la promotion des médicaments.
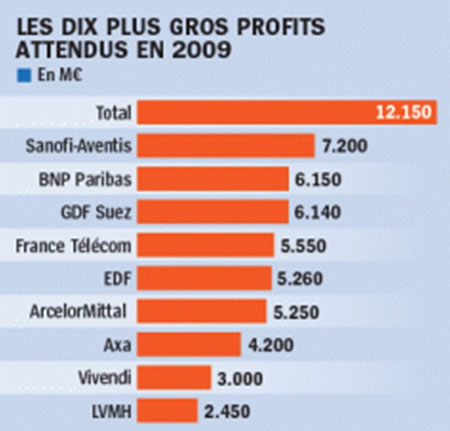 En France en 2004 :
En France en 2004 :
Les firmes dépensaient en promotion 25000 euros par an et par médecin d'après le rapport de l'IGAS.
La visite médicale coûte plus d'un milliard d'euros par an.
Les congrès 120 millions.
Représentant de l'Etat ou représentant des Big pharma?
Les dirigeants politiques de tous les grands pays industrialisés ont confié les hauts postes de l'administration du médicament à des personnes qui venaient de l'industrie du médicament arguant de leur compétence sans se préoccuper de leur objectivité.
L'influence de ces réformes a progressivement fait oublier l'objectif fondateur des agences (la sécurité sanitaire) pour favoriser essentiellement l'intérêt de l'industrie.
Aux Etats-Unis d'Amérique
Le "Medicament Act" a officialisé la primauté de l'intérêt des grande firmes pharmaceutiques sur la sécurité sanitaire en exigeant que les procédures d'autorisation de mise sur le marché soient les plus rapides possibles.
Pour le permettre, de nombreux "employés" de la Drug and Food Administration sont recrutés et officiellement salariés par les entreprises du médicaments.
Experts représentant l'état ou représentant des big pharma?
Professeur d'université, Chef de service hospitalier, Chercheur, Expert de l'AFSSAPS, Membre de la Haute Autorité de Santé, Conseiller du Ministre de la santé, Promoteurs d'essais, Conseiller de laboratoire, Président de société savante...
Peut on s'étonner de la facilité avec laquelle les médicaments sont déclarés "novateurs" "avec une balance efficacité risque très positive".
L'application inverse du principe de précaution
On demande peu de preuves d'efficacité et d'innocuité pour autoriser un médicament. Mais on exige des preuves certaines et lourdes de sa toxicité pour le retirer du marché!
La peur de rétorsions (légales ou illégales) des laboratoires paralysent également les agences lorsqu'un retrait se discute.
Le gendarme a peur de l'éventuel délinquant !
Bénéfices mesurables des représentants des big pharma
Gains financiers directs : honoraires de conseil, paiement de manifestations promotionnelles présentées sous forme d'enseignement, actions de la société, emploi d'un membre de la famille, promesse de pantouflage juteux...
Prise en charge de frais : prêt de personnel ou de matériel coûteux, inscription aux congrès.
Cadeaux en nature : matériels et logiciels informatiques billets d'avions, paiement d'hôtel ou de restaurants de luxe.
Bénéfices secondaires : la face cachée de l'iceberg
Les firmes assurent aux "leaders d'opinion" qu'elles emploient la reconnaissance professionnelle grâce à la puissante logistique événementielle des firmes (congrès, symposiums, colloques, presse).
L'appartenance à un groupe "reconnu", l'acceptation des communications en congrès et des articles dans les grandes revues internationales, ce qui permet à la faculté de vous "distinguer" plus rapidement pour vous nommer médecin hospitalier titulaire ou professeur.
La notoriété dans le milieu médical passe invariablement par la soumission aux codes en cours, de fait aux essais thérapeutiques subventionnés au moins à 80% par l'industrie pharmaceutique.
Il existe une hiérarchie des rétributions selon l'utilité des intervenants :
Quelques centaines d'euros pour un médecin.
Quelques milliers pour un investigateur qui inclue des malades dans un essai.
Quelques dizaines ou centaines de milliers d'euros pour le promoteur d'un essai, un leader d'opinion, un ministre ou un membre important du ministère, un expert l'OMS, un comité Nobel...
Cumul des leaders d'opinion
Leurs activités sont parfois très (trop) nombreuses et concurrentielles :
Enseignement des étudiants,
Formation continue des médecins,
Auteur dans la presse aussi bien grand public que professionnelle,
Président de société savante,
Promoteur d'essais thérapeutiques,
Expert dans les agences gouvernementales de régulation,
Conseiller de l'industrie pharmaceutique.
Des essais peu fiables
Les essais thérapeutiques sont conçus, financés, réalisés, analysés par les laboratoires.
Ils restent leur totale propriété peuvent être publiés ou non selon l'intérêt des firmes.
Les données brutes sont secrètes.
Toutes les manipulations, falsifications, dissimulations sont possibles et ont été démontrées dans tous les scandales récents.
Essais thérapeutiques de possibles blockbusters
Leurs promoteurs sont rétribués trop grassement par les laboratoires (parfois plusieurs centaines de milliers d'euros) et leur jugement s'en trouve gravement altéré en faveur du médicament.
De même les statisticiens chargés de l'analyse de l'essai savent qu'ils doivent non pas établir une vérité scientifique mais démontrer l'efficacité du produit s'ils veulent conserver leur client.
Les manipulations des données brutes sont possibles et fréquentes lorsque l'essai ne remplit pas son but réel : affirmer l'efficacité du produit.
Les procédures d'AMM facilitent les manipulations
Les dossiers sont préparés par les firmes qui mettent en forme les essais les plus flatteurs pour leur médicament.
Il n'existe aucun débat contradictoire puisque l'instruction repose uniquement sur une partie (les labos).
Le dossier est secret.
Les décisions sont connues mais jamais leurs motivations ni le détail des débats.
Procédure digne de l'inquisition.
Dans tous les pays démocratiques les débats en justice sont publics et contradictoires. "A charge et à décharge".
A l'inverse, les jugements actuels d'AMM sont secrets et instruits uniquement par le laboratoire.
Dans tous les pays démocratiques les juge sont payés par l'Etat et ne doivent en aucun cas avoir de lien quelconque avec l'une de parties qui se présentent devant eux. Dans la commission d'AMM presqu'aucun expert n'est indépendant des laboratoires. Presque tous en vivent et parfois très largement.
Conflits des experts
Les conflits d'intérêt des experts constituent en fait la pratique courante puisque ce sont les mêmes personnes qui passent des ministères à la tête des entreprises privées ou vice versa ou qui sont en même temps experts, professeurs des universités, directeurs des unités de recherche.
Les déclarations des conflits sont obligatoires mais aucune sanction n'est prévue en cas de déclaration inexistante ou fausse.
On ne compte plus les auditions d'experts présentant des conflits majeurs. On observe de nombreux conflits chez les membres permanents des commissions.
Le poids des liens d'intérêt des experts de l'AFSSAPS a été très récemment pointé par l'IGAS :
"Il s'agit des liens d'intérêts financiers ou d'autres natures tels qu'ils devraient être signalés à l'Agence, ce qui n'est pas à l'heure actuelle. Or ces règles procédurales ont été établies dès1993 lors de la création de l'Agence. Il n'est que temps de les faire appliquer "sans faille et sans exception".
Cette conception des liens d'intérêt doit être élargie, doit d'abord être envisagée dans le temps. Deux des responsables les plus importants de l'Agence, au moins, ont ainsi contracté, après avoir quitté leurs fonctions respectives, des liens financiers avec les laboratoires Servier.
Dans ces 2 cas, il s'agissait de professeurs des universités-praticiens hospitaliers, médecins dont le statut les met pour l'heure à l'abri de la commission de déontologie, qui s'est déclarée en 2000 incompétente en la matière."
Suivi inexistant
Après la mise sur le marché les agences n'entreprennent que très exceptionnellement des études complémentaires sur la toxicité éventuelle.
Les firmes tenues de déclarer les accidents éventuels n'ont aucun intérêt à le faire et minorent systématiquement les incidents.
La plupart des membres de la commission de pharmacovigilance et la société scientifique de pharmacologie sont largement sponsorisés par l'industrie.
Ces conflits d'intérêt expliquent en très grande partie les "incompréhensibles défaillances" du système de pharmacovigilance relevées par l'IGAS dans le scandale du Médiator.
Comme aux Etats-Unis d'Amérique
Ces failles majeures de sécurité sanitaire avaient été soulignées en 2005 par le docteur Graham devant la commission d'enquête du Sénat Américain sur le scandale du Vioxx.
Sans que cela n'alerte nos agences françaises.
Sans tentative apparente de correction depuis lors...
Corruption de ministres
En 1991. Le Président de Smithkline Beecham qui fabrique le vaccin anti-hépatite B a avoué avoir donné à Francesco de Lorenzo, ministre italien de la santé 600 millions de lires quelques mois avant que ce dernier rende la vaccination obligatoire dans son pays.
"Attaquer notre vaccin c'est attaquer la France." Jean Yves Garnier, président de Pasteur Vaccin, après un article sur le vaccin contre l'hépatite B, 1983.
Corruption Mafieuse en Italie
Paolo Cirino Pomicino, ancien ministre du Budget et le Pr. Duilio Poggiolini, membre influent des instances européennes du Médicament qui fut aussi à la tête de la Direction du médicament dans son pays et Président de l'Ordre des médecins et plus d'une soixantaine d'autres membres tout puissants du ministère de la Santé ont également été condamnés pour diverses fautes graves que le Giornale per la protezione della salute (n° 6, mars 1998) qualifiait de "pratiques mafieuses".
De leur côté, les laboratoires Sandoz - qui deviendront Novartis - se contentaient de mettre un hélicoptère à la disposition de Paolo Cirino Pomicino.
L'information fit la une des journaux italiens, puis fut reprise par un journal pharmaceutique international Scrip, qui publia les montants des pots-de-vin distribués par des laboratoires pharmaceutiques tels Glaxo, Pfizer, Shering et SmithKline Beecham... La presse française s'est abstenue de parler de cet immense scandale.
De telles pratiques auraient-elles été réservées à des hommes politiques italiens ?
Corruption de ministre en Chine
L'ancien directeur de l'Administration d'Etat des médicaments, Zheng Xiaoyu, arrêté en 2005 a été reconnu coupable d'avoir touché 6,4 millions de yuans (620.000 euros) de pots-de-vin d'entreprises pharmaceutiques. Il a été exécuté en 2007 après le rejet par la Cour suprême de son appel.
Conflit d'intérêt à l'OMS
Jadis financée uniquement par les gouvernements l'Organisation Mondiale pour la Santé l'est de plus en plus par les firmes (actuellement 70%).
Les firmes sont donc de plus en plus présentes dans les organes de décision sans déclaration de conflits d'intérêts de leurs membres.
Cette situation explique au moins en partie les scandales récents dont celui de la grippe aviaire et de la déclaration de pandémie de la grippe porcine.
Le professeur O expert OMS pour la grippe affirma en 2005 que, jusqu'à 30% de tous les oiseaux d'Europe transportaient le virus de la grippe aviaire H5N1et que les éleveurs en contact avec des poules et des poulets se trouvaient exposés.
Lorsqu'un vétérinaire néerlandais trouva la mort en 2005 il annonça que sa mort résultait d'une contamination par le virus H5N1. Il convainquit le Parlement néerlandais d'exiger l'abattage de millions de poulets. Dans la presse il prétendit que le virus, avoir provoqué plusieurs décès aux antipodes, allait se propager en Europe.
A la fin de l'épidémie, 200 millions d'oiseaux environ avaient été victimes du virus ou abattus à titre préventif et 171 personnes reconnues infectées dans le monde (93 en sont mortes). Aucun risque significatif de contamination interhumaine n'a été démontré.
Mais les gouvernements et l'Organisation mondiale de la santé ont constitué des stocks de Tamiflu octroyant au laboratoire Roche des bénéfices record, rapportant près de 5 milliards de francs suisses en 2006 et 2007.
Création de la psychose de la grippe AH1N1
La "grippette" apparue en 2009 au Mexique provoqua une épidémie. Les laboratoires surent mieux valoriser cette épidémie que de la précédente : ils réussirent, en plus du Tamiflu à vendre une montagne de vaccins !
En avril 2009, au moment où étaient signalés les premiers cas. Les critères de définition de pandémie ont été modifiée par l'OMS de manière à déclarer "l'état pandémique" non pas sur le risque réel de maladie mais sur le nombre de cas de la maladie concernée.
Wayden M, journaliste, ancien officier de la marine américaine répétait : "...C'est une forme de virus très inhabituelle qui semble être le résultat de manipulations génétiques. Il contient une forme de grippe aviaire, deux formes de grippes humaines et des formes de grippes porcines..."
Panique amplifiée en France
Le Pr Antoine F. épidémiologiste estimait que "la létalité directement liée à la grippe A(H1N1) serait environ 100 fois supérieure à celle observée pour la grippe saisonnière" et prônait "une utilisation du Tamiflu plus large qu'actuellement".
Un virologue marseillais, Didier R, prétendait "on court à la catastrophe".
Roselyne Bachelot participait activement à diffuser l'angoisse en affirmant le 25 novembre 2009 lors d'une visite de collège : "Il est extrêmement important de se faire vacciner, pour soi et pour les autres car cette grippe n'est pas une grippe comme les autres. Elle a des formes graves et elle touche des publics jeunes.
A ces jeunes qui doutent, j'ai envie de les emmener dans un service de réanimation pour leur montrer un jeune avec les poumons complètement détruits, par la grippe H1N1, ce qu'on ne voit pas avec la grippe saisonnière".
L'opinion des laboratoires relayée par leurs experts prévaut
Le 10 décembre 2009, la Direction générale de la santé annonce que les traitements antiviraux Tamiflu® mais aussi Relenza® étaient désormais justifiés chez tous les patients ayant une grippe.
Pourtant 12 décembre 2009, le British Medical Journal publiait un article qui montrant que cet antiviral réduisait seulement d'une journée la durée des symptômes cliniques et accusait Roche d'avoir trompé les médecins et les gouvernements sur les bénéfices du Tamiflu.
Les auteurs ont admis qu'ils ont écrit les études publiées en tant qu'"auteurs fantômes". L'un deux a même détaillé les instructions que le département commercial de Roche lui donnait :
"dans l'introduction, je devais annoncer que la grippe était un problème très important et je devais arriver à la conclusion que le Tamiflu® en était la réponse".
Vaccination contre la grippe de grippe H1N1
Dès les premiers cas de grippe H1N1 la ministre, s'appuyant sur les conseils (désintéressés ?) de ses experts décide de vacciner toute la population après avoir consulté la cour constitutionnelle sur la constitutionnalité d'une loi imposant une vaccination à l'ensemble de la population.
Elle signe rapidement un contrat de réservation de 94 millions de doses de vaccins pour 808 millions d'euros.
Impunité pour les firmes américaines
L'industrie pharmaceutique a de plus retiré de cette grande peur un avantage incroyable :
celui d'être exempté de tout recours des victimes éventuelles contre leurs produits en cas d'utilisation en situation d'urgence (même en cas de grossière négligence de leur part).
L'aide du leader républicain au sénat américain monsieur Frist a été déterminante.
L'industrie pharmaceutique a été reconnaissante puisque le trois membres du sénat à l'origine de cette loi se sont partagés 1 200 000 dollars de dons depuis l'an 2000.
Vaccin Gardasil et conflit d'intérêt dans le comité Nobel
Pr Bo A, membre votant du comité du prix Nobel de médecine, siège parallèlement au conseil d'administration d'Astra Zeneca depuis le 25 juillet 2007. La firme lui a versé 30000 dollars en 2007.
Le président du comité Nobel qui décerne le prix de médecine, Bertil Fredholm, a travaillé en tant que consultant pour Astra Zeneca.
Ils ont couronné le scientifique vedette d' Astra Zeneca, Harald zur Hausen (caution scientifique du Gardasil), après que le laboratoire ait versé indirectement plusieurs millions de dollars à deux filiales de la Fondation Nobel.
Médecins leaders d'opinion
Ils influencent la population au travers d'articles dans la presse grand public ou d'émissions télévisées supposées informer sur les progrès des traitements ou les risques des maladies.
Il n'est jamais fais mention de leurs liens avec les laboratoires malgré les lois qui le stipulent formellement.
Ces leaders d'opinion sont parfois payés 7000 euros pour un exposé d'une heure en congrès.
Mais aussi les chercheurs
Aux Etats-Unis un chercheur à l'Institut National de santé Américain a été inculpé de violation de la loi sur le conflit d'intérêt criminelle parce qu'il avait omis de déclarer les liens financiers qu'il avait avec le géant de la pharmacie le groupe Pfizer.
Il a été accusé d'avoir accepté 285 000$.
Sunderland a reconnu avoir touché 25.000 $ par année, ainsi qu'une somme de 2500 $ pour assister à une journée de réunions avec l'entreprise, entre 1997 et 2004 pendant que des études étaient en cours entre le NIH et Pfizer.
Sunderland avait fait un arrangement similaire pour recevoir 25000 dollars de plus par an de Pfizer au cours d'une autre étude de deux bio marqueurs.
Peut on croire les recommandations?
Les groupes qui rédigent les recommandations sont infiltrés par l'industrie à un niveau inégalé :
Sur 200 groupes de recommandations mondiales, déclarés en 2004 aux Etats-Unis, seuls 90 contiennent des détails sur les conflits d'intérêts de leurs auteurs et seulement 31 de ces derniers sont libres de toute influence industrielle.
Plus d'un tiers des groupes comprend au moins un membre titulaire d'actions de la compagnie dont on étudie le médicament.
Formation post universitaire des médecins sous contrôle
La formation continue des médecins, rendue obligatoire par la loi, est presque uniquement prise en charge par l'industrie pharmaceutique.
Ce problème majeur d'indépendance, théoriquement facilement soluble si on le veut n'a jamais été résolu.
Ces "formations" assurées, ou au moins sponsorisées par un laboratoire qui distribue ses publicités en plus du buffet donnent droit à des points pour montrer qu'on a validé la formation continue obligatoire.
En résumé se faire acheter devient une obligation légale.
Peut on assainir la chaîne du médicament ?
Les principes sont simples et connus de tous depuis longtemps.
Les appliquer nécessite un réel courage politique pour affronter des groupes de pression très puissants et très bien organisés.
1°) Un principe de base : la sécurité de la population prime sur l'intérêt de l'industrie pharmaceutique.
Une première mesure est l'application stricte du principe de précaution:
Un médicament susceptible d'être dangereux doit être retiré du marché à titre conservatoire et non pas "mis sous surveillance" comme le propose l'AFSSAPS.
2°) Changer le régime de propriété des essais destinés à une demande d'AMM
Ne doivent plus être la propriété exclusive des industriels mais bénéficier d'un régime de copropriété industriel - malades inclus dans l'essai et leurs associations - agences du médicaments et de la sécurité sociale.
L'authenticité d'un essai thérapeutique destiné à une demande d'AMM ne doit plus pouvoir être mise en doute.
Il doit donc être déclaré d'emblée comme tel puis être certifié par un enregistrement annuel auprès des agences du médicament sur le modèle du dépôt des comptes d'une société commerciale (avec au minimum le nombre de malades inclus leur âge, sexe, et caractéristiques principales).
Toute exclusion de malade d'un essai devant faire l'objet d'une déclaration précisant les motifs de l'exclusion.
3°) Authentifier les essais thérapeutiques AMM
Il est indispensable d'instaurer une obligation d'enregistrement central de toute recherche.
Cette possibilité existe actuellement (clinicaltrials.gov de l'US National Institute of Health), en dehors de toute obligation.
Il faut aussi imposer une prépublication du protocole d'étude et ensuite exiger un contrôle, lors de la publication de la recherche, du respect du protocole initial.
4°) Contrôleur ou contrôlé il faut choisir
La déclaration des conflits d'intérêt est utile mais l'expérience prouve qu'elle est inefficace.
Les membres des commissions AFSSAPS qui prétendent que leurs liens avec l'industrie témoignent seulement de leur "grande expertise" se sont révélés incapables de refuser l'AMM du Vioxx ni de s'apercevoir que le Médiator était une amphétamine.
De simples médecins qui ne disposaient ni des données du dossier d'AMM, ni de leurs moyens d'investigations ont d'emblée reconnu et publié leurs doutes sur l'efficacité et l'innocuité de ces médicaments tueurs et prédit leur futur retrait du marché.
Aucun expert d'une agence gouvernementale ne doit avoir de lien avec l'industrie qu'il contrôle.
Le problème le plus préoccupant est celui des conflits d'intérêts
Les déclarations de conflit d'intérêt ont été partout et toujours soit non respectées soit inefficaces.
La solution aux conflits d'intérêts nécessite leur suppression totale
Il faut choisir son camp : régulateur ou régulé.
Pour devenir membre d'un organisme de contrôle et tout particulièrement responsable de l'autorisation de mise sur le marché ou des prix ou des taux de remboursement
Il est indispensable de n'avoir aucun conflit d'intérêt. Cette exclusion pourrait avoir une durée limitée, peut être trois ans avant la prise de fonction dans une commission et cinq ans après.
Cette exclusion totale existe ailleurs
Un policier ne peut être conseiller d'une association de malfaiteurs...
Un juge ne donne pas de conseils à un une entreprise en délicatesse avec la loi...
Un arbitre de football n'accepte pas les subsides d'un club...
Un contrôleur des impôts ne peut pas recevoir des avantages d'une personne contrôlée.
La protection de notre sécurité sanitaire mérite l'exclusivité.
Une réforme efficace nécessite l'éradication des conflits d'intérêts qu'aucune expertise utile ne justifie et que seuls expliquent, l'avidité des experts, et l'intérêt financier de l'industrie pharmaceutique.
A l'université de Stanford les directives sont claires
Elles mentionnent, entre autres, qu'aucune forme de cadeau personnel ne peut être acceptée, dans aucune circonstance pour les activités de formation au niveau de la transparence des conflits d'intérêt, du choix des thèmes, du contenu des présentations.
L'université prévoit également une formation pour les étudiants, résidents, stagiaires et personnel, sur les conflits d'intérêt.
Plus récemment, un consensus interuniversitaire étatsunien rappelle la nécessité de placer l'intérêt des patients avant celui des chercheurs, de leurs services ou celui de tiers.
Ce consensus a établi une règlementation analysant les bénéfices et les risques d'un partenariat entre les mondes académique et industriel pharmaceutique (LO 2010).


